NaCl Là Chất Điện Li Mạnh Hay Yếu? Điều này sẽ được yukenfucoidan giải đáp trong bài viết sau đây. Mời bạn đọc cùng theo dõi và tìm hiểu!
NaCl là gì? NaCl Là Chất Điện Li Mạnh Hay Yếu?
NaCl, hay còn gọi là natri clorua, là một hợp chất hóa học phổ biến, được biết đến với tên gọi quen thuộc là muối ăn. NaCl có công thức phân tử là NaCl, có khối lượng phân tử là 58,44 g/mol.
NaCl có dạng vật lý là tinh thể màu trắng, không mùi, tan tốt trong nước và các dung môi phân cực khác.
NaCl có nhiều ứng dụng trong cuộc sống, như làm gia vị, bảo quản thực phẩm, điều hòa nước trong cơ thể, sản xuất các hóa chất khác như natri hydroxit, clo, natri cacbonat…
NaCl là chất điện li gì?

Để trả lời câu hỏi NaCl là chất điện li gì, ta cần hiểu khái niệm chất điện li là gì. Chất điện li là chất khi tan trong nước hoặc dung môi phân cực khác, các phân tử hòa tan bị phân li thành các ion dương và âm. Các ion này có khả năng dẫn điện trong dung dịch. Chất điện li được chia thành hai loại: chất điện li mạnh và chất điện li yếu.
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan phân li hoàn toàn thành các ion. Những chất điện li mạnh thường là các axit mạnh (như HCl, HNO3, H2SO4…), các bazơ mạnh (như NaOH, KOH, Ca(OH)2…) và hầu hết các muối (như NaCl, KCl, KNO3…).
Chất điện li yếu là chất khi tan trong nước, chỉ có một phần nhỏ các phân tử hòa tan phân li thành các ion, phần lớn vẫn giữ nguyên dạng phân tử. Những chất điện li yếu thường là các axit yếu (như CH3COOH, HF, H2CO3…), các bazơ yếu (như NH3, CH3NH2…) và một số muối ít tan (như AgCl, PbSO4…).
NaCl là chất điện li mạnh hay yếu?

Dựa trên định nghĩa trên, ta có thể kết luận rằng NaCl là chất điện li mạnh. Lý do là vì NaCl có thể tan hoàn toàn trong nước và các phân tử hòa tan đều bị phân li thành các ion âm và dương, là ion Na+ và Cl-.
Nếu trong dung dịch có 99 phân tử NaCl hòa tan thì cả 99 phân tử đều phân li ra ion
Phương trình điện li của NaCl trong nước được viết như sau:
NaCl → Na+ + Cl-
Có thể thấy rằng trong dung dịch NaCl không còn tồn tại phân tử NaCl nào. Điều này khác với trường hợp của các chất điện li yếu, ví dụ như HF (axit fluorhydric).
HF khi tan trong nước chỉ có một lượng nhỏ các phân tử HF phân li thành ion H+ và F-, còn lại vẫn giữ nguyên dạng HF. Phương trình điện li của HF trong nước được viết như sau:
HF ⇌ H+ + F-
Có thể thấy rằng trong dung dịch HF vẫn còn tồn tại phân tử HF, và phương trình điện li là thuận nghịch, có nghĩa là phản ứng phân li có thể xảy ra theo cả hai chiều.
Tại sao NaCl là chất điện li mạnh?

Để giải thích tại sao NaCl là chất điện li mạnh, ta cần xét đến các yếu tố sau:
- Bản chất của liên kết hóa học trong phân tử NaCl.
- Sự tương tác giữa các ion Na+ và Cl- với phân tử nước.
- Độ tan của NaCl trong nước.
Bản chất của liên kết hóa học trong phân tử NaCl
NaCl là một hợp chất ion, có nghĩa là các nguyên tử Na và Cl kết hợp với nhau bằng cách trao đổi electron. Nguyên tử Na có số electron lớp ngoài cùng là 1, nguyên tử Cl có số electron lớp ngoài cùng là 7.
Khi Na và Cl kết hợp, nguyên tử Na sẽ nhường electron lớp ngoài cùng cho nguyên tử Cl, từ đó tạo ra ion Na+ và ion Cl-. Các ion này sẽ bị thu hút với nhau bởi lực hút Coulomb, tạo thành liên kết ion.
Liên kết ion trong NaCl có đặc điểm là rất mạnh, vì sự chênh lệch điện tích giữa các ion là rất lớn. Điều này làm cho các ion khó bị tách ra khỏi nhau trong trạng thái rắn.
Tuy nhiên, khi NaCl tan trong nước, các phân tử nước sẽ can thiệp vào liên kết ion, làm giảm sự thu hút giữa các ion và tạo ra các ion hydrat. Điều này dẫn đến sự phân li hoàn toàn của NaCl trong dung dịch.
Sự tương tác giữa các ion Na+ và Cl- với phân tử nước
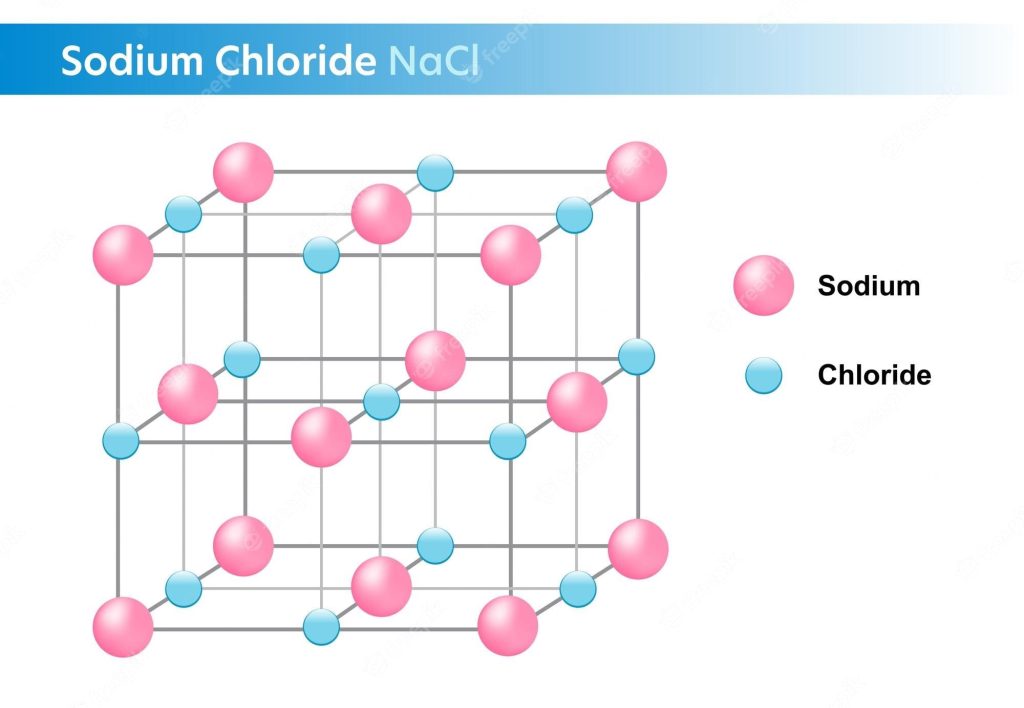
Nước là một dung môi phân cực, có nghĩa là các phân tử nước có sự phân bố không đồng đều của điện tích. Phân tử nước có hai nguyên tử hiđro và một nguyên tử oxy, được kết hợp bởi liên kết cộng hóa trị.
Do oxy có độ âm điện cao hơn hiđro, nên oxy sẽ hút electron về phía mình, tạo ra điện tích âm trên oxy và điện tích dương trên hiđro.
Điều này làm cho phân tử nước có một đầu mang điện tích âm và một đầu mang điện tích dương.
Khi NaCl tan trong nước, các phân tử nước sẽ bao quanh các ion Na+ và Cl-, tạo ra các ion hydrat. Các ion hydrat là các ion được bọc bởi một lớp phân tử nước. Các phân tử nước sẽ sắp xếp sao cho đầu mang điện tích ngược dấu với ion ở trung tâm.
Ví dụ, ion Na+ sẽ được bao quanh bởi các phân tử nước có đầu oxy (mang điện tích âm) hướng về trung tâm. Ion Cl- sẽ được bao quanh bởi các phân tử nước có đầu hiđro (mang điện tích dương) hướng về trung tâm.
Độ tan của NaCl trong nước
Độ tan của NaCl trong nước là một yếu tố quan trọng để xác định NaCl là chất điện li mạnh hay yếu. Độ tan của NaCl trong nước được định lượng bằng hằng số tan (Ksp), là tích nồng độ của các ion trong dung dịch bão hòa. Công thức tính Ksp của NaCl là:
Ksp = [Na+][Cl-]
Trong đó, [Na+] và [Cl-] là nồng độ mol/lít của các ion Na+ và Cl- trong dung dịch bão hòa.
Độ tan của NaCl trong nước là rất cao, khoảng 35,7 g/100 ml ở 20°C. Điều này có nghĩa là NaCl có thể tan được rất nhiều trong nước, tạo ra dung dịch có nồng độ ion cao. Ksp của NaCl ở 25°C là 36,1 g/100 ml, tương đương với 5,4 x 10^-2 mol/lít. Điều này cho thấy rằng NaCl có Ksp rất lớn, và do đó là chất điện li mạnh.
Ngược lại, các chất điện li yếu thường có độ tan thấp trong nước, và do đó có Ksp nhỏ. Ví dụ, AgCl (muối bạc clorua) là một chất điện li yếu, vì khi tan trong nước chỉ có một lượng nhỏ các phân tử AgCl phân li thành ion Ag+ và Cl-, còn lại vẫn giữ nguyên dạng kết tinh.
Độ tan của AgCl trong nước rất thấp, chỉ khoảng 0,002 g/100 ml ở 25°C. Ksp của AgCl ở 25°C là 1,8 x 10^-10 mol/lít, tương đương với 1,3 x 10^-5 mol/lít. Điều này cho thấy rằng AgCl có Ksp rất nhỏ, và do đó là chất điện li yếu.
Trên đây là những thông tin giải đáp về thắc mắc NaCl Là Chất Điện Li Mạnh Hay Yếu? yukenfucoidan Hy vọng bài viết này của tôi hữu ích với bạn.



